Marcado láser UDI en la industria médica
Etiquetado uniforme de dispositivos médicos para aumentar la seguridad del paciente y la transparencia en la cadena de suministro
La implementación de la Directiva UDI de identificación única de dispositivos es obligatoria para los fabricantes de dispositivos médicos. Esto no solo es cierto para las empresas que venden sus productos en el mercado estadounidense, ya que UDI también se está implementando en la UE y otros países.
Los productos médicos deben estar claramente identificados para garantizar una trazabilidad segura y la seguridad del paciente. Además del marcaje de empaques y etiquetas, esto también se aplica al marcaje directo de productos de alto riesgo como implantes e instrumentos.
Los fabricantes deben mantener plazos y requisitos para implementar sistemas de marcaje para aplicar el marcaje de acuerdo con los requisitos UDI y las normas médicas. Para implementar los exigentes requisitos de etiquetado, serialización y marcaje, se requieren tecnologías apropiadas que permitan aplicar y verificar los códigos con alta resolución, permanencia con una calidad excepcional y, si es necesario, incluso en los espacios más pequeños.

Fechas de cumplimiento FDA y MDR
El sistema de UDI se estructura en etapas según el nivel de riesgo de clasificación de los productos, comenzando con los productos de la clase de riesgo más alta. Encuentra a continuación los plazos de etiquetado para los productos fabricados o importados en los Estados Unidos.
Plazo
Requisitos de conformidad
26 de mayo de 2021: entrada en vigor de MDR (pospuesto desde 2020 debido a la crisis de Coronavirus)
- Solicitud de UDI.
- Cumplimiento de la gestión de calidad interna y la documentación técnica con los requisitos de MDR.
- Designación de un responsable UDI en las empresas.
- Más requisitos de notificación a corto plazo en caso de defectos del producto y obligación de comunicar incidencias a la EUDAMED.
- Sistema de Vigilancia de Dispositivos Médicos/Post-Market Surveillance: El control de riesgos y la seguridad del paciente deben indicarse dentro de los tres años posteriores al lanzamiento comercial de un producto.
- Los productos recién introducidos necesitan certificación MDR.
- Todos los productos existentes necesitan recertificación. Para los productos de clase O, hay una extensión del plazo hasta 2024 (ver más abajo).
Mayo 26, 2021
UDI en etiquetas y envases de productos clase III.
Mayo 26, 2022
Implementación de la base de datos EUDAMED y registro de datos en la base de datos EUDAMED.
Mayo 26, 2023
- Marcaje directo de piezas de dispositivos de clase III, si el dispositivo está destinado a usarse más de una vez durante un período de tiempo y debe reprocesarse antes de cada uso.
- UDI en etiquetas y envases de productos clase IIa y IIb.
Mayo 26, 2024
Ampliación de plazo: Los productos Clase Ir que ya han sido aprobados según MDD y no han sido modificados pueden permanecer en el mercado y no tienen que ser recertificados hasta 2024.
Mayo 26, 2024
Fin de la eliminación de productos que ya han sido aprobados según MDD.
Mayo 26, 2025
- Marcaje directo de piezas de dispositivos de clase II, si el dispositivo está destinado a usarse más de una vez durante un período de tiempo y debe reprocesarse antes de cada uso.
- UDI en etiquetas y envases de productos clase I.
Mayo 26, 2027
Marcaje directo de piezas de dispositivos de clase I, si el dispositivo está destinado a usarse más de una vez durante un período de tiempo y debe procesarse antes de cada uso.
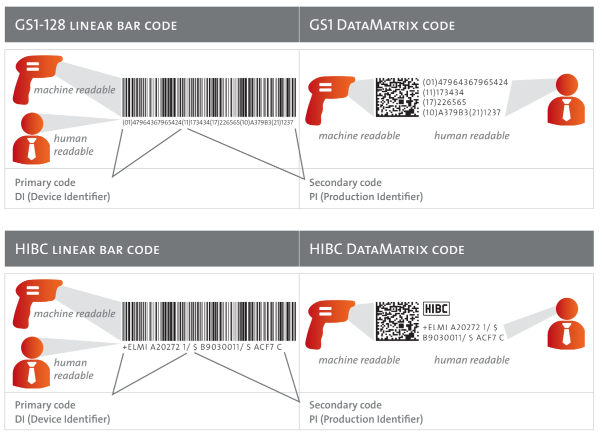
Confiable y único: Formato de código y estructura de un código UDI
De acuerdo con 21 CFR 81.40, los dispositivos médicos deben llevar un UDI que se representa de dos formas:
- Texto sin formato fácilmente legible (HRI/interpretación legible por humanos), caracteres alfanuméricos.
- Tecnología AIDC (Identificación Automática y Captura de Datos), lo que significa un código legible por máquina (código de barras/código 2D).
En caso de que el código UDI se aplique como una marca directa permanente, debe estar en uno o ambos (1) texto sin formato de fácil lectura y (2) Formulario AIDC o tecnología alternativa (ver 21 CFR 801.45). Incluso en las áreas más pequeñas, el UDI se puede marcar como un código Datamatrix de formato pequeño.
Marcaje de identificación de productos seguro y confiable
Desafíos y soluciones para fabricantes y etiquetadores
Los requisitos para la identificación de dispositivos médicos son altos. Lo que es más, son los requisitos especiales en el etiquetado UDI. Los sistemas de marcaje innovadores no solo resuelven estos desafíos, sino que también contribuyen a incrementar la eficiencia de la producción y mejorar la calidad del producto.
Requisitos de los sistemas de marcaje
Los requisitos para el marcaje de dispositivos médicos son sumamente estrictos. Las marcas tienen que ser:
- Permanentes y trazables
- Legibles y leíbles
- Altas en contraste
- A prueba de falsificaciones
- Resistentes a la esterilización
- Higiénicas, limpias, biocompatibles
- Y en el caso de metales como el inoxidable, resistentes a la corrosión

Tomar la decisión correcta: Tecnología para el marcaje de productos
Uno de los principales retos a los que se enfrenta UDI es la implementación de la tecnología de marcaje directo adecuada. La FDA no especifica cuál de las diversas opciones disponibles se debe utilizar. Además, no todos los métodos son adecuados para un marcaje directo de piezas seguro y compatible con UDI; por lo tanto, elegir el mejor método para cumplir con los requisitos puede ser difícil y crucial.
Posibles métodos de marcaje
Marcaje láser
Inyección de tinta (CIJ, inyección de tinta continua)
Inyección de tinta térmica (TIJ)
Etiquetas
Pluma de punto
Sobre todo, el marcaje láser es ideal para el marcado directo de dispositivos médicos con el Identificador Único de Dispositivo. Cumple con todos los criterios relevantes para el marcaje seguro de productos según los estándares médicos y los requisitos UDI.
Ventajas del marcaje láser
El marcaje láser, en combinación con un sistema de cámara integrado en la máquina, ofrece numerosas ventajas:
- Confiabilidad del proceso, producción eficiente y optimizada: Marcaje preciso y muy repetible mediante el sistema de cámara integrado; procesos de marcado estables; tiempos de procesamiento cortos.
- Marcas sin errores: Alta calidad de marcaje constante; posicionamiento preciso del contenido correcto en el producto correcto; menos chatarra.
- Trazabilidad confiable: Marcas permanentes y altamente legibles para una identificación segura del producto; OCV (Verificación Óptica de Caracteres) y lectura de códigos.
- Marcas seguras según lo requerido por los estándares médicos: Marcas biocompatibles, resistentes a la esterilización y la limpieza; procedimiento higiénico sin contacto.

¡Tenemos un equipo listo para atenderte!
Envíanos un mensaje y uno de nuestros expertos se pondrá en contacto contigo a la brevedad.

